











前 言
本標準代替GB/T4789.6—2003《食品衛生微生物學檢驗 致瀉大腸埃希氏菌檢驗》。
本標準與GB/T4789.6—2003相比,主要變化如下:
———標準名稱修改為“食品安全國家標準 食品微生物學檢驗 致瀉大腸埃希氏菌檢驗”;
———增加了術語和定義、縮略語;
———增加了血清學試驗中H 抗原鑒定;
———增加了PCR確認試驗;
———增加了附錄A;
———修改了設備和材料;
———修改了培養基和試劑;
———修改了檢驗程序;
———修改了血清學試驗中致瀉大腸埃希氏菌所包括的O 抗原群;
———刪除了腸毒素試驗。
1 範圍
本標準規定了食品中致瀉大腸埃希氏菌(diarrheagenicEscherichiacoli)的檢驗方法。
本標準適用於食品中致瀉大腸埃希氏菌的檢驗。
2 術語和定義、縮略語
2.1 術語和定義
下列術語和定義適用於本文件。
2.1.1 致瀉大腸埃希氏菌 DiarrheagenicEscherichiacoli
一類能引起人體以腹瀉症狀為主的大腸埃希氏菌,可經過汙染食物引起人類發病。常見的致瀉大腸埃希氏菌主要包括腸道致病性大腸埃希氏菌、腸道侵襲性大腸埃希氏菌、產腸毒素大腸埃希氏菌、產誌賀毒素大腸埃希氏菌(包括腸道出血性大腸埃希氏菌)和腸道集聚性大腸埃希氏菌。
2.1.2 腸道致病性大腸埃希氏菌 EnteropathogenicEscherichiacoli
能夠引起宿主腸黏膜上皮細胞黏附及擦拭性損傷,且不產生誌賀毒素的大腸埃希氏菌。該菌是嬰幼兒腹瀉的主要病原菌,有高度傳染性,嚴重者可致死。
2.1.3 腸道侵襲性大腸埃希氏菌 EnteroinvasiveEscherichiacoli
能夠侵入腸道上皮細胞而引起痢疾樣腹瀉的大腸埃希氏菌。該菌無動力、不發生賴氨酸脫羧反應、不發酵乳糖,生化反應和抗原結構均近似痢疾誌賀氏菌。侵入上皮細胞的關鍵基因是侵襲性質粒上的抗原編碼基因及其調控基因,如ipaH 基因、ipaR 基因(又稱為invE 基因)。
2.1.4 產腸毒素大腸埃希氏菌 EnterotoxigenicEscherichiacoli
能夠分泌熱穩定性腸毒素或/和熱不穩定性腸毒素的大腸埃希氏菌。該菌可引起嬰幼兒和旅遊者腹瀉,一般呈輕度水樣腹瀉,也可呈嚴重的霍亂樣症狀,低熱或不發熱。腹瀉常為自限性,一般2d~3d即自愈。
2.1.5 產誌賀毒素大腸埃希氏菌 Shigatoxin-producingEscherichiacoli(腸道出血性大腸埃希氏菌EnterohemorrhagicEscherichiacoli)
能夠分泌誌賀毒素、引起宿主腸黏膜上皮細胞黏附及擦拭性損傷的大腸埃希氏菌。有些產誌賀毒素大腸埃希氏菌在臨床上引起人類出血性結腸炎(HC)或血性腹瀉,並可進一步發展為溶血性尿毒綜合征(HUS),這類產誌賀毒素大腸埃希氏菌為腸道出血性大腸埃希氏菌。
2.1.6 腸道集聚性大腸埃希氏菌 EnteroaggregativeEscherichiacoli
腸道集聚性大腸埃希氏菌不侵入腸道上皮細胞,但能引起腸道液體蓄積。不產生熱穩定性腸毒素或熱不穩定性腸毒素,也不產生誌賀毒素。唯一特征是能對Hep-2細胞形成集聚性黏附,也稱Hep-2細胞黏附性大腸埃希氏菌。
2.2 縮略語
下列縮略語適用於本文件。
2.2.1 DEC:致瀉大腸埃希氏菌 DiarrheagenicEscherichiacoli
2.2.2 EPEC:腸道致病性大腸埃希氏菌 EnteropathogenicEscherichiacoli
2.2.3 EIEC:腸道侵襲性大腸埃希氏菌 EnteroinvasiveEscherichiacoli
2.2.4 ETEC:產腸毒素大腸埃希氏菌 EnterotoxigenicEscherichiacoli
2.2.5 STEC:產誌賀毒素大腸埃希氏菌 Shigatoxin-producingEscherichiacoli
2.2.6 EHEC:腸道出血性大腸埃希氏菌 EnterohemorrhagicEscherichiacoli
2.2.7 EAEC:腸道集聚性大腸埃希氏菌 EnteroaggregativeEscherichiacoli
2.2.8 escV:蛋白分泌物調節基因,geneencodingLEE-encodedtypeⅢsecretionsystemfactor
2.2.9 eae:緊密素基因,geneencodingintiminforEscherichiacoliattachingandeffacing
2.2.10 bfpB:束狀菌毛B基因,bundle-formingpilusB;
2.2.11 stx1:誌賀毒素Ⅰ基因,Shigatoxinone
2.2.12 stx2:誌賀毒素Ⅱ基因,Shigatoxintwo
2.2.13 lt:熱不穩定性腸毒素基因,heat-labileenterotoxin
2.2.14 st:熱穩定性腸毒素基因,heat-stableenterotoxin
2.2.15 stp (stIa):豬源熱穩定性腸毒素基因,heat-stableenterotoxinsinitiallydiscoveredintheisolatesfrompigs
2.2.16 sth (stIb):人源熱穩定性腸毒素基因,heat-stableenterotoxinsinitiallydiscoveredintheisolatesfromhuman
2.2.17 invE:侵襲性質粒調節基因,invasiveplasmidregulator
2.2.18 ipaH :侵襲性質粒抗原H 基因,invasiveplasmidantigenH-gene
2.2.19 aggR:集聚黏附菌毛調節基因,aggregativeadhesivefimbriaeregulator
2.2.20 uidA :β-葡萄糖苷酶基因,β-glucuronidasegene
2.2.21 astA :集聚熱穩定性毒素A 基因,enteroaggregativeheat-stableenterotoxinA
2.2.22 pic:腸定植因子基因,proteininvolvedinintestinalcolonization
2.2.23 LEE:腸細胞損傷基因座,Locusofenterocyteeffacement
2.2.24 EAF:EPEC黏附因子,EPECadhesivefactor
3 設備和材料
除微生物實驗室常規滅菌及培養設備外,其他設備和材料如下:
3.1 恒溫培養箱:36℃±1℃,42℃±1℃。
3.2 冰箱:2℃~5℃。
3.3 恒溫水浴箱:50℃±1℃,100℃或適配1.5mL或2.0mL金屬浴(95℃~100℃)。
3.4 電子天平:感量為0.1g和0.01g。
3.5 顯微鏡:10×~100×。
3.6 均質器。
3.7 振蕩器。
3.8 無菌吸管:1mL(具0.01mL刻度),10mL(具0.1mL刻度)或微量移液器及吸頭。
3.9 無菌均質杯或無菌均質袋:容量500mL。
3.10 無菌培養皿:直徑90mm。
3.11 pH 計或精密pH 試紙。
3.12 微量離心管:1.5mL或2.0mL。
3.13 接種環:1μL。
3.14 低溫高速離心機:轉速≥13000r/min,控溫4℃~8℃。
3.15 微生物鑒定係統。
3.16 PCR儀。
3.17 微量移液器及吸頭:0.5μL~2μL,2μL~20μL,20μL~200μL,200μL~1000μL。
3.18 水平電泳儀:包括電源、電泳槽、製膠槽(長度>10cm)和梳子。
3.19 8聯排管和8聯排蓋(平蓋/凸蓋)。
3.20 凝膠成像儀。
4 培養基和試劑
4.1 營養肉湯:見A.1。
4.2 腸道菌增菌肉湯:見A.2。
4.3 麥康凱瓊脂(MAC):見A.3。
4.4 伊紅美藍瓊脂(EMB):見A.4。
4.5 三糖鐵(TSI)瓊脂:見A.5。
4.6 蛋白腖水、靛基質試劑:見A.6。
4.7 半固體瓊脂:見A.7。
4.8 尿素瓊脂(pH7.2):見A.8。
4.9 氰化鉀(KCN)培養基:見A.9。
4.10 氧化酶試劑:見A.10。
4.11 革蘭氏染色液:見A.11。
4.12 BHI肉湯:見A.12。
4.13 福爾馬林(含38%~40%甲醛)。
4.14 鑒定試劑盒。
4.15 大腸埃希氏菌診斷血清。
4.16 滅菌去離子水。
4.17 0.85%滅菌生理鹽水。
4.18 TE(pH8.0):見A.13。
4.19 10×PCR反應緩衝液:見A.14。
4.20 25mmol/L MgCl2。
4.21 dNTPs:dATP、dTTP、dGTP、dCTP每種濃度為2.5mmol/L。
4.22 5U/LTaq酶。
4.23 引物。
4.24 50×TAE電泳緩衝液:見A.15。
4.25 瓊脂糖。
4.26 溴化乙錠(EB)或其他核酸染料。
4.27 6×上樣緩衝液:見A.16。
4.28 Marker:分子量包含100bp、200bp、300bp、400bp、500bp、600bp、700bp、800bp、900bp、1000bp、1500bp條帶。
4.29 致瀉大腸埃希氏菌PCR試劑盒。
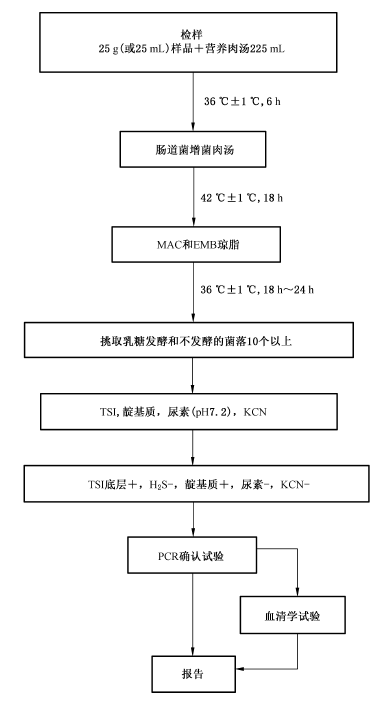
5 檢驗程序
致瀉大腸埃希氏菌檢驗程序見圖1。
6 操作步驟
6.1 樣品製備
6.1.1 固態或半固態樣品
固體或半固態樣品,以無菌操作稱取檢樣25g,加入裝有225mL營養肉湯的均質杯中,用旋轉刀片式均質器8000r/min~10000r/min均質1min~2min;或加入裝有225mL營養肉湯的均質袋中,用拍擊式均質器均質1min~2min。
6.1.2 液態樣品
以無菌操作量取檢樣25mL,加入裝有225mL營養肉湯的無菌錐形瓶(瓶內可預置適當數量的無菌玻璃珠),振蕩混勻。
6.2 增菌
將6.1製備的樣品勻液於36℃±1℃培養6h。取10μL,接種於30mL腸道菌增菌肉湯管內,於42℃±1℃培養18h。
6.3 分離
將增菌液劃線接種MAC和EMB瓊脂平板,於36 ℃±1 ℃培養18h~24h,觀察菌落特征。在MAC瓊脂平板上,分解乳糖的典型菌落為磚紅色至桃紅色,不分解乳糖的菌落為無色或淡粉色;在EMB瓊脂平板上,分解乳糖的典型菌落為中心紫黑色帶或不帶金屬光澤,不分解乳糖的菌落為無色或淡粉色。
6.4 生化試驗
6.4.1 選取平板上可疑菌落10個~20個(10個以下全選),應挑取乳糖發酵,以及乳糖不發酵和遲緩發酵的菌落,分別接種TSI斜麵。同時將這些培養物分別接種蛋白腖水、尿素瓊脂(pH7.2)和KCN 肉湯。於36℃±1℃培養18h~24h。
6.4.2 TSI斜麵產酸或不產酸,底層產酸,靛基質陽性,H2S陰性和尿素酶陰性的培養物為大腸埃希氏菌。TSI斜麵底層不產酸,或H2S、KCN、尿素有任一項為陽性的培養物,均非大腸埃希氏菌。必要時做革蘭氏染色和氧化酶試驗。大腸埃希氏菌為革蘭氏陰性杆菌,氧化酶陰性。
6.4.3 如選擇生化鑒定試劑盒或微生物鑒定係統,可從營養瓊脂平板上挑取經純化的可疑菌落用無菌稀釋液製備成濁度適當的菌懸液,使用生化鑒定試劑盒或微生物鑒定係統進行鑒定。
6.5 PCR 確認試驗
6.5.1 取生化反應符合大腸埃希氏菌特征的菌落進行PCR確認試驗。
注:PCR實驗室區域設計、工作基本原則及注意事項應參照《疾病預防控製中心建設標準》(建標127—2009)和國家衛生和計劃生育委員會(原衛生部)(2010)《醫療機構臨床基因擴增管理辦法》附錄(醫療機構臨床基因擴增檢驗實驗室工作導則)。
6.5.2 使用1μL接種環刮取營養瓊脂平板或斜麵上培養18h~24h的菌落,懸浮在200μL0.85%滅菌生理鹽水中,充分打散製成菌懸液,於13000r/min離心3min,棄掉上清液。加入1mL滅菌去離子水充分混勻菌體,於100℃水浴或者金屬浴維持10min;冰浴冷卻後,13000r/min離心3min,收集上清液;按1∶10的比例用滅菌去離子水稀釋上清液,取2μL作為PCR檢測的模板;所有處理後的DNA
模板直接用於PCR 反應或暫存於4 ℃並當天進行PCR 反應;否則,應在-20 ℃以下保存備用(1周內)。也可用細菌基因組提取試劑盒提取細菌DNA,操作方法按照細菌基因組提取試劑盒說明書進行。
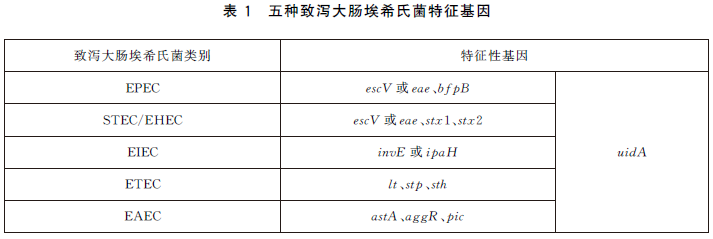
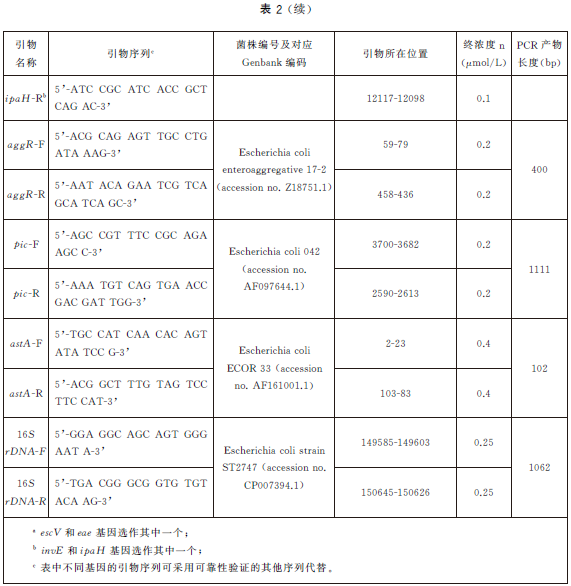
6.5.3 每次PCR反應使用EPEC、EIEC、ETEC、STEC/EHEC、EAEC標準菌株作為陽性對照。同時,使用大腸埃希氏菌ATCC25922或等效標準菌株作為陰性對照,以滅菌去離子水作為空白對照,控製PCR體係汙染。致瀉大腸埃希氏菌特征性基因見表1。
表1 五種致瀉大腸埃希氏菌特征基因
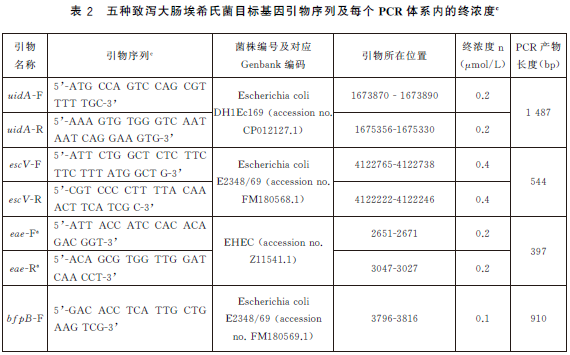
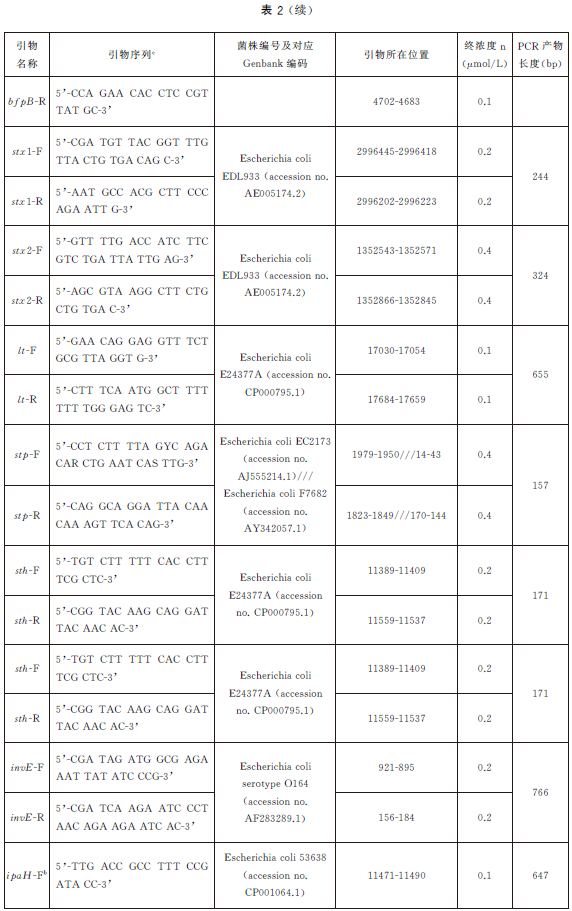
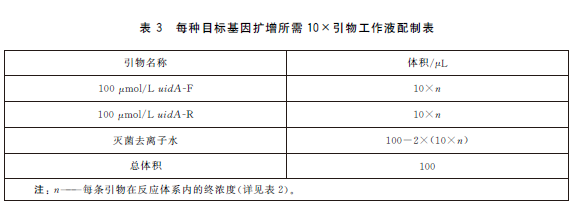
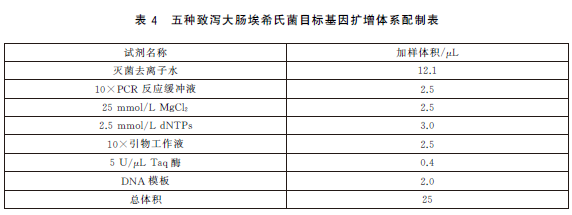
6.5.4 PCR反應體係配製。每個樣品初篩需配置12個PCR擴增反應體係,對應檢測12個目標基因,具體操作如下:使用TE溶液(pH8.0)將合成的引物幹粉稀釋成100μmol/L儲存液。根據表2中每種目標基因對應PCR體係內引物的終濃度,使用滅菌去離子水配製12種目標基因擴增所需的10×引物工作液(以uidA 基因為例,如表3)。將10×引物工作液、10×PCR 反應緩衝液25mmol/L MgCl2、2.5mmol/LdNTPs、滅菌去離子水從-20 ℃冰箱中取出,融化並平衡至室溫,使用前混勻;5U/μLTaq 酶在加樣前從-20℃冰箱中取出。每個樣品按照表4的加液量配製12個25μL反應體係,分別使用12種目標基因對應的10×引物工作液。
6.5.5 PCR循環條件。預變性94℃5min;變性94℃30s,複性63℃30s,延伸72℃1.5min,30個循環;72℃延伸5min。將配製完成的PCR反應管放入PCR儀中,核查PCR反應條件正確後,啟動反應程序。
6.5.6 稱量4.0g瓊脂糖粉,加入至200mL的1×TAE電泳緩衝液中,充分混勻。使用微波爐反複加熱至沸騰,直到瓊脂糖粉完全融化形成清亮透明的溶液。待瓊脂糖溶液冷卻至60℃左右時,加入溴化乙錠(EB)至終濃度為0.5μg/mL,充分混勻後,輕輕倒入已放置好梳子的模具中,凝膠長度要大於10cm,厚度宜為3mm~5mm。檢查梳齒下或梳齒間有無氣泡,用一次性吸頭小心排掉瓊脂糖凝膠中的氣泡。當瓊脂糖凝膠完全凝結硬化後,輕輕拔出梳子,小心將膠塊和膠床放入電泳槽中,樣品孔放置在陰極端。向電泳槽中加入1×TAE電泳緩衝液,液麵高於膠麵1mm~2mm 。將5μLPCR產物與1μL6×上樣緩衝液混勻後,用微量移液器吸取混合液垂直伸入液麵下膠孔,小心上樣於孔中;陽性對照的PCR反應產物加入到最後一個泳道;第一個泳道中加入2μL分子量Marker。接通電泳儀電源,根據公式:電壓=電泳槽正負極間的距離(cm)×5V/cm 計算並設定電泳儀電壓數值;啟動電壓開關,電泳開始以正負極鉑金絲出現氣泡為準。電泳30min~45min後,切斷電源。取出凝膠放入凝膠成像儀中觀察結果,拍照並記錄數據。
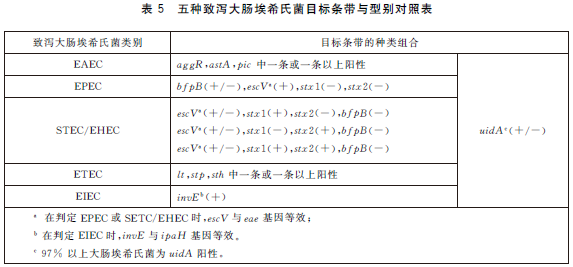
6.5.7 結果判定。電泳結果中空白對照應無條帶出現,陰性對照僅有uidA 條帶擴增,陽性對照中出現所有目標條帶,PCR試驗結果成立。根據電泳圖中目標條帶大小,判斷目標條帶的種類,記錄每個泳道中目標條帶的種類,在表5中查找不同目標條帶種類及組合所對應的致瀉大腸埃希氏菌類別。
6.5.8 如用商品化PCR試劑盒或多重聚合酶鏈反應(MPCR)試劑盒,應按照試劑盒說明書進行操作和結果判定。
6.6 血清學試驗(選做項目)
6.6.1 取PCR試驗確認為致瀉大腸埃希氏菌的菌株進行血清學試驗。
注:應按照生產商提供的使用說明進行O 抗原和H 抗原的鑒定。當生產商的使用說明與下麵的描述可能有偏差時,按生產商提供的使用說明進行。
6.6.2 O 抗原鑒定
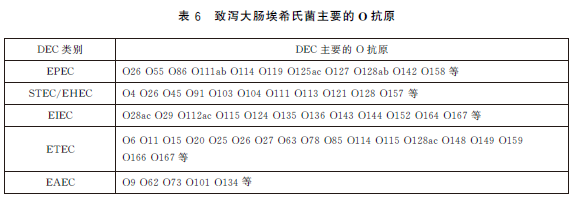
6.6.2.1 假定試驗:挑取經生化試驗和PCR試驗證實為致瀉大腸埃希氏菌的營養瓊脂平板上的菌落,根據致瀉大腸埃希氏菌的類別,選用大腸埃希氏菌單價或多價OK 血清做玻片凝集試驗。當與某一種多價OK血清凝集時,再與該多價血清所包含的單價OK 血清做凝集試驗。致瀉大腸埃希氏菌所包括的O 抗原群見表6。如與某一單價OK血清呈現凝集反應,即為假定試驗陽性。
6.6.2.2 證實試驗:用0.85%滅菌生理鹽水製備O 抗原懸液,稀釋至與MacFarland3號比濁管相當的濃度。原效價為1∶160~1∶320的O 血清,用0.5%鹽水稀釋至1∶40。將稀釋血清與抗原懸液於10mm×75mm 試管內等量混合,做單管凝集試驗。混勻後放於50℃±1℃水浴箱內,經16h後觀察結果。如出現凝集,可證實為該O 抗原。
6.6.3 H 抗原鑒定
6.6.3.1 取菌株穿刺接種半固體瓊脂管,36℃±1 ℃培養18h~24h,取頂部培養物1環接種至BHI液體培養基中,於36℃±1℃培養18h~24h。加入福爾馬林至終濃度為0.5%,做玻片凝集或試管凝集試驗。
6.6.3.2 若待測抗原與血清均無明顯凝集,應從首次穿刺培養管中挑取培養物,再進行2次~3次半固體管穿刺培養,按照6.6.3.1進行試驗。
7 結果報告
7.1 根據生化試驗、PCR確認試驗的結果,報告25g(或25mL)樣品中檢出或未檢出某類致瀉大腸埃希氏菌。
7.2 如果進行血清學試驗,根據血清學試驗的結果,報告25g(或25mL)樣品中檢出的某類致瀉大腸埃希氏菌血清型別。
附 錄 A
培養基和試劑
A.1 營養肉湯
A.1.1 成分
蛋白腖 10.0g
牛肉膏3.0g
氯化鈉5.0g
蒸餾水1000mL
A.1.2 製法
將以上成分混合加熱溶解,冷卻至25 ℃左右校正pH 至7.4±0.2,分裝適當的容器。121 ℃滅菌15min。
A.2 腸道菌增菌肉湯
A.2.1 成分
蛋白腖10.0g
葡萄糖5.0g
牛膽鹽20.0g
磷酸氫二鈉8.0g
磷酸二氫鉀2.0g
煌綠0.015g
蒸餾水1000mL
A.2.2 製法
將以上成分混合加熱溶解,冷卻至25 ℃左右校正pH 至7.2±0.2,分裝每瓶30mL。115 ℃滅菌20min。
A.3 麥康凱瓊脂(MAC)
A.3.1 成分
蛋白腖20.0g
乳糖10.0g
3號膽鹽1.5g
氯化鈉5.0g
中性紅0.03g
結晶紫0.001g
瓊脂15.0g
蒸餾水1000mL
A.3.2 製法
將以上成分混合加熱溶解,校正pH 至7.2±0.2。121℃高壓滅菌15min。冷卻至45℃~50℃,傾注平板。
注:如不立即使用,在2℃~8℃條件下可儲存兩周。
A.4 伊紅美藍(EMB)瓊脂
A.4.1 成分
蛋白腖10.0g
乳糖10.0g
磷酸氫二鉀(K2HPO4) 2.0g
瓊脂15.0g
2%伊紅Y水溶液20.0mL
0.5%美藍水溶液13.0mL
蒸餾水1000mL
A.4.2 製法
在1000mL蒸餾水中煮沸溶解蛋白腖、磷酸鹽和乳糖,加水補足,冷卻至25 ℃左右校正pH 至7.1±0.2。再加入瓊脂,121℃高壓滅菌15min。冷至45℃~50℃,加入2%伊紅Y水溶液和0.5%美藍水溶液,搖勻,傾注平皿。
A.5 三糖鐵瓊脂(TSI)
A.5.1 成分
蛋白腖20.0g
牛肉浸膏5.0g
乳糖10.0g
蔗糖10.0g
葡萄糖1.0g
硫酸亞鐵銨[(NH4)2Fe(SO4)2·6H2O] 0.2g
氯化鈉5.0g
硫代硫酸鈉0.2g
酚紅0.025g
瓊脂12.0g
蒸餾水1000mL
A.5.2 製法
除酚紅和瓊脂外,將其他成分加於400mL水中,攪拌均勻,靜置約10min,加熱使完全溶化,冷卻至25℃左右校正pH 至7.4±0.2。另將瓊脂加於600mL水中,靜置約10min,加熱使完全溶化。將兩溶液混合均勻,加入5%酚紅水溶液5 mL,混勻,分裝小號試管,每管約3 mL。於121 ℃ 滅菌15min,製成高層斜麵。冷卻後呈桔紅色。如不立即使用,在2℃~8℃條件下可儲存一個月。
A.6 蛋白腖水、靛基質試劑
A.6.1 成分
胰蛋白腖20.0g
氯化鈉5.0g
蒸餾水1000mL
A.6.2 製法
將以上成分混合加熱溶解,冷卻至25 ℃左右校正pH 至7.4±0.2,分裝小試管,121 ℃高壓滅菌15min。
注:此試劑在2℃~8℃條件下可儲存一個月。
A.6.3 靛基質試劑
A.6.3.1 柯凡克試劑:將5g對二甲氨基苯甲醛溶解於75mL戊醇中。然後緩慢加入濃鹽酸25mL。
A.6.3.2 歐-波試劑:將1g 對二甲氨基苯甲醛溶解於95 mL95%乙醇內。然後緩慢加入濃鹽酸20mL。
A.6.4 試驗方法
挑取少量培養物接種,在36℃±1℃培養1d~2d,必要時可培養4d~5d。加入柯凡克試劑約0.5mL,輕搖試管,陽性者於試劑層呈深紅色;或加入歐-波試劑約0.5mL,沿管壁流下,覆蓋於培養液表麵,陽性者於液麵接觸處呈玫瑰紅色。
A.7 半固體瓊脂
A.7.1 成分
蛋白腖1.0g
牛肉膏0.3g
氯化鈉0.5g
瓊脂0.3g~0.5g
蒸餾水100.0mL
A.7.2 製法
按以上成分配好,加熱溶解,冷卻至25 ℃左右校正pH 至7.4±0.2,分裝小試管。121 ℃滅菌15min,直立凝固備用。
A.8 尿素瓊脂(pH7.2)
A.8.1 成分
蛋白腖1.0g
氯化鈉5.0g
葡萄糖1.0g
磷酸二氫鉀2.0g
0.4%酚紅3.0mL
瓊脂20.0g
20%尿素溶液100.0mL
蒸餾水1000mL
A.8.2 製法
除酚紅、尿素和瓊脂外的其他成分加熱溶解,冷卻至25℃左右校正pH 至7.2±0.2,加入酚紅指示劑,混勻,於121℃滅菌15min。冷至約55℃,加入用0.22μm 過濾膜除菌後的20%尿素水溶液100mL,混勻,以無菌操作分裝滅菌試管,每管約3mL~4mL,製成斜麵後放冰箱備用。
A.8.3 試驗方法
挑取瓊脂培養物接種,在36℃±1℃培養24h,觀察結果。尿素酶陽性者由於產堿而使培養基變為紅色。
A.9 氰化鉀(KCN)培養基
A.9.1 成分
蛋白腖10.0g
氯化鈉5.0g
磷酸二氫鉀0.225g
磷酸氫二鈉5.64g
0.5%氰化鉀20.0mL
蒸餾水1000mL
A.9.2 製法
將除氰化鉀以外的成分加入蒸餾水中,煮沸溶解,分裝後121 ℃高壓滅菌15min。放在冰箱內使其充分冷卻。每100mL培養基加入0.5%氰化鉀溶液2.0mL(最後濃度為1∶10000),分裝於無菌試管內,每管約4mL,立刻用無菌橡皮塞塞緊,放在4℃冰箱內,至少可保存兩個月。同時,將不加氰化鉀的培養基作為對照培養基,分裝試管備用。
A.9.3 試驗方法
將瓊脂培養物接種於蛋白腖水內成為稀釋菌液,挑取1環接種於氰化鉀(KCN)培養基。並另挑取1環接種於對照培養基。在36℃±1℃培養1d~2d,觀察結果。如有細菌生長即為陽性(不抑製),經2d細菌不生長為陰性(抑製)。
注:氰化鉀是劇毒藥,使用時應小心,切勿沾染,以免中毒。夏天分裝培養基應在冰箱內進行。試驗失敗的主要原因是封口不嚴,氰化鉀逐漸分解,產生氫氰酸氣體逸出,以致藥物濃度降低,細菌生長,因而造成假陽性反應。試驗時對每一環節都要特別注意。
A.10 氧化酶試劑
A.10.1 成分
N ,N ’-二甲基對苯二胺鹽酸鹽或
N ,N ,N ’,N ’-四甲基對苯二胺鹽酸鹽1.0g
蒸餾水100mL
A.10.2 製法
少量新鮮配製,於2℃~8℃冰箱內避光保存,在7d內使用。
A.10.3 試驗方法
用無菌棉拭子取單個菌落,滴加氧化酶試劑,10s內呈現粉紅或紫紅色即為氧化酶試驗陽性,不變色者為氧化酶試驗陰性。
A.11 革蘭氏染色液
A.11.1 結晶紫染色液
A.11.1.1 成分
結晶紫1.0g
95%乙醇20.0mL
1%草酸銨水溶液80.0mL
A.11.1.2 製法
將結晶紫完全溶解於乙醇中,然後與草酸銨溶液混合。
A.11.2 革蘭氏碘液
A.11.2.1 成分
碘1.0g
碘化鉀2.0g
蒸餾水300mL
A.11.2.2 製法
將碘與碘化鉀先行混合,加入蒸餾水少許充分振搖,待完全溶解後,再加蒸餾水至300mL。
A.11.3 沙黃複染液
A.11.3.1 成分
沙黃0.25g
95%乙醇10.0mL
蒸餾水90.0mL
A.11.3.2 製法
將沙黃溶解於乙醇中,然後用蒸餾水稀釋。
A.11.4 染色法
A.11.4.1 塗片在火焰上固定,滴加結晶紫染液,染1min,水洗。
A.11.4.2 滴加革蘭氏碘液,作用1min,水洗。
A.11.4.3 滴加95%乙醇脫色約15s~30s,直至染色液被洗掉,不要過分脫色,水洗。
A.11.4.4 滴加複染液,複染1min,水洗、待幹、鏡檢。
A.12 BHI肉湯
A.12.1 成分
小牛腦浸液200g
牛心浸液250g
蛋白腖10.0g
NaCl 5.0g
葡萄糖2.0g
磷酸氫二鈉(Na2HPO4) 2.5g
蒸餾水1000mL
A.12.2 製法
按以上成分配好,加熱溶解,冷卻至25 ℃左右校正pH 至7.4±0.2,分裝小試管。121 ℃滅菌15min。
A.13 TE(pH8.0)
A.13.1 成分
1mol/LTris-HCl(pH8.0) 10.0mL
0.5mol/LEDTA(pH8.0) 2.0mL
滅菌去離子水988mL
A.13.2 製法
將1mol/LTris-HCl緩衝液(pH8.0)、0.5mol/LEDTA 溶液(pH8.0)加入約800mL滅菌去離子水均勻,再定容至1000mL,121℃高壓滅菌15min,4℃保存。
A.14 10×PCR 反應緩衝液
A.14.1 成分
1mol/LTris-HCl(pH8.5) 840mL
氯化鉀(KCl) 37.25g
滅菌去離子水160mL
A.14.2 製法
將氯化鉀溶於1mol/LTris-HCl(pH8.5),定容至1000mL,121℃高壓滅菌15min,分裝後-20℃保存。
A.15 50×TAE電泳緩衝液
A.15.1 成分
Tris 242.0g
EDTA-2Na(Na2EDTA·2H2O) 37.2g
冰乙酸(CH3COOH) 57.1mL
滅菌去離子水942.9mL
A.15.2 製法
Tris和EDTA-2Na溶於800mL滅菌去離子水,充分攪拌均勻;加入冰乙酸,充分溶解;用1mol/lNaOH 調pH 至8.3,定容至1L後,室溫保存。使用時稀釋50倍即為1×TAE電泳緩衝液。
A.16 6×上樣緩衝液
A.16.1 成分
溴酚藍0.5g
二甲苯氰FF 0.5g
0.5mol/LEDTA(pH8.0) 0.06mL
甘油360mL
滅菌去離子水640mL
A.16.2 製法
0.5mol/LEDTA(pH8.0)溶於500mL滅菌去離子水中,加入溴酚藍和二甲苯氰FF溶解,與甘油混合,定容至1000mL,分裝後4℃保存。

