











微生物計數法係用於能在有氧條件下生長的嗜溫細菌和真菌的計數。
當本法用於檢查非無菌製劑及其原、輔料等是否符合相應的微生物限度標準時,應按下述規定進行檢驗,包括樣品的取樣量和結果的判斷等。除另有規定外,本法不適用於活菌製劑的檢査。
微生物計數試驗環境應符合微生物限度檢查的要求。檢驗全過程必須嚴格遵守無菌操作,防止再汙染,防止汙染的措施不得影響供試品中微生物的檢出。單向流空氣區域、工作台麵及環境應定期進行監測。
如供試品有抗菌活性,應盡可能去除或中和。供試品檢査時,若使用了中和劑或滅活劑,應確認其有效性及對微生物無毒性。
供試液製備時如果使用了表麵活性劑,應確認其對微生物無毒性以及與所使用中和劑或滅活劑的相容性。
計數方法
計數方法包括平皿法、薄膜過濾法和最可能數法(Most-Probable-Number Method, 簡稱 MPN 法)。MPN 法用於微生物計數時精確度較差,但對於某些微生物汙染量很小的供試品,M P N法可能是更適合的方法。
供試品檢查時,應根據供試品理化特性和微生物限度標準等因素選擇計數方法,檢測的樣品量應能保證所獲得的試驗結果能夠判斷供試品是否符合規定。所選方法的適用性須經確認。
計數培養基適用性檢査和供試品計數方法適用性試驗
供試品微生物計數中所使用的培養基應進行適用性檢查。
供試品的微生物計數方法應進行方法適用性試驗,以確認所采用的方法適合於該產品的微生物計數。
若檢驗程序或產品發生變化可能影響檢驗結果時,計數方法應重新進行適用性試驗。
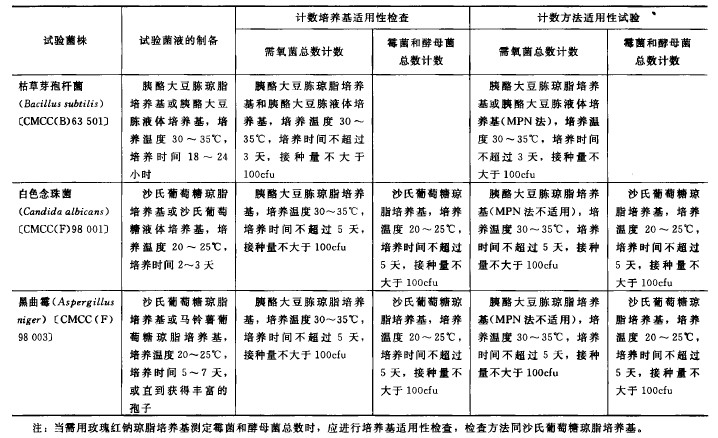
菌種及菌液製備
菌種 試驗用菌株的傳代次數不得超過5 代(從菌種保藏中心獲得的幹燥菌種為第0 代),並采用適宜的菌種保藏技術進行保存,以保證試驗菌株的生物學特性。計數培養基適用性檢查和計數方法適用性試驗用菌株見表1。
菌液製備 按表1 規定程序培養各試驗菌株。取金黃色葡萄球菌、銅綠假單胞菌、枯草芽孢杆菌、白色念珠菌的新鮮培養物,用PH7.0無菌氣化鈉-蛋白腖緩衝液或0.9%無菌氣化鈉溶液製成適宜濃度的菌懸液;取黑曲黴的新鮮培養物加人3〜5ml含0. 05% (m l/m l)聚山梨酯8 0的pH7_0無菌氯化鈉-蛋白腖緩衝液或0.9%無菌氣化鈉溶液,將孢子洗脫。然後,采用適宜的方法吸出孢子懸液至無菌試管內,用含0. 05%(ml/ml)聚山梨酯8 0的pH7. 0 無菌氣化鈉-蛋白腖緩衝液或0. 9%無菌氣化鈉溶液製成適宜濃度的黑曲黴孢子懸液。
菌液製備後若在室溫下放置,應在2 小時內使用;若保存在2〜8*C,可在2 4小時內使用。黑曲黴孢子懸液可保存在2〜8 ° C ,在驗證過的貯存期內使用。
陰性對照
為確認試驗條件是否符合要求,應進行陰性對照試驗,陰性對照試驗應無菌生長。如陰性對照有菌生長,應進行偏差調查。
培養基適用性檢査
微生物計數用的成品培養基、由脫水培養基或按處方配製的培養基均應進行培養基適用性檢查。
按表1 規定,接種不大於lOOcfu的菌液至胰酪大豆腖液體培養基管或胰酪大豆腖瓊脂培養基平板或沙氏葡萄糖瓊脂培養基平板,置表1 規定條件下培養。每一試驗菌株平行製備2 管或2 個平皿。同時,用相應的對照培養基替代被檢培養基進行上述試驗。
被檢固體培養基上的菌落平均數與對照培養基上的菌落平均數的比值應在0.5〜2 範圍內,且菌落形態大小應與對照培養基上的菌落一致;被檢液體培養基管與對照培養基管比較,試驗菌應生長良好。
計數方法適用性試驗
1. 供試液製備
根據供試品的理化特性與生物學特性,采取適宜的方法製備供試液。供試液製備若需加溫時,應均勻加熱,且溫度不應超過45#C 。供試液從製備至加人檢驗用培養基,不得超過1 小時。
常用的供試液製備方法如下。如果下列供試液製備方法經確認均不適用,應建立其他適宜的方法。
(1)水溶性供試品 取供試品,用PH7.0無菌氣化鈉-蛋白腖緩衝液,或PH7. 2磷酸鹽緩衝液,或胰酪大豆腖液體培養基溶解或稀釋製成1 : 1 0供試液。若需要,調節供試液p H值至6〜8。必要時,用同一稀釋液將供試液進一步1 0倍係列稀釋。水溶性液體製劑也可用混合的供試品原液作為供試液。
(2)水不溶性非油脂類供試品 取供試品,用pH7. 0 無菌氯化鈉-蛋白腖緩衝液,或PH7. 2 磷酸鹽緩衝液,或胰酪大豆腖液體培養基製備成1 : 1 0供試液。分散力較差的供試品,可在稀釋液中加人表麵活性劑如0 . 1 %的聚山梨酯80,使供試品分散均勻。若需要,調節供試液p H 值至6〜8。必要時,用同一稀釋液將供試液進一步1 0倍係列稀釋。
(3 )油脂類供試品 取供試品,加人無菌十四烷酸異丙酯使溶解,或與最少量並能使供試品乳化的無菌聚山梨酯8 0或其他無抑菌性的無菌表麵活性劑充分混勻。表麵活性劑的溫度一般不超過4 0 t:(特殊情況下,最多不超過45°C) ,小心混合,若需要可在水浴中進行,然後加人預熱的稀釋液使成1 : 1 0 供試液,保溫,混合,並在最短時間內形成乳狀液。必要時,用稀釋液或含上述表麵活性劑的稀釋液進一步10倍係列稀釋。
(4 )需用特殊方法製備供試液的供試品
膜劑供試品 取供試品,剪碎,加P H 7 .0無菌氯化鈉-蛋白腖緩衝液,或P H 7 .2磷酸鹽緩衝液,或胰酪大豆腖液體培養基,浸泡,振搖,製成1 : 1 0的供試液。若需要,調節供試液p H 值至6〜8。必要時,用同一稀釋液將供試液進一步10倍係列稀釋。
腸溶及結腸溶製劑供試品 取供試品,加人P H 6 .8無菌磷酸鹽緩衝液(用於腸溶製劑)或PH7. 6 無菌磷酸鹽緩衝液(用於結腸溶製劑),置45X:水浴中,振搖,使溶解,製成1 : 1 0 的供試液。必要時,用同一稀釋液將供試液進一步10倍係列稀釋。
氣霧劑、噴霧劑供試品 取供試品,置一20°C或其他適宜溫度冷凍約1小時,取出,迅速消毒供試品開啟部位,用無菌鋼錐在該部位鑽一小孔,放至室溫,並輕輕轉動容器,使拋射劑緩緩全部釋出。供試品亦可采用其他適宜的方法取出。用無菌注射器從每一容器中吸出藥液於無菌容器中混合,然後取樣檢査。
貼裔劑供試品 取供試品,去掉防粘層,將粘貼麵朝上放置在無菌玻璃或塑料器皿上,在粘貼麵上覆蓋一層適宜的無菌多孔材料(如無菌紗布),避免貼膏劑粘貼在一起。將處理後的貼膏劑放入盛有適宜體積並含有表麵活性劑(如聚山梨酯8 0或卵磷脂)稀釋液的容器中,振蕩至少3 0分鍾。必要時,用同一稀釋液將供試液進一步10倍係列稀釋。
2. 接種和稀釋
按下列要求進行供試液的接種和稀釋,製備微生物回收試驗用供試液。所加菌液的體積應不超過供試液體積的1%。為確認供試品中的微生物能被充分檢出,首先應選擇最低稀釋級的供試液進行計數方法適用性試驗。
(1)試驗組 取上述製備好的供試液,加入試驗菌液,混勻,使每lm l供試液或每張濾膜所濾過的供試液中含菌量不大於lOOcfu。
(2 )供試品對照組 取製備好的供試液,以稀釋液代替菌液同試驗組操作。
(3)菌液對照組 取不含中和劑及滅活劑的相應稀釋液替代供試液,按試驗組操作加人試驗菌液並進行微生物回收試驗。
若因供試品抗菌活性或溶解性較差的原因導致無法選擇最低稀釋級的供試液進行方法適用性試驗時,應采用適宜的方法對供試%液進行進一步的處理。如果供試品對微生物生長的抑製作用無法以其他方法消除,供試液可經過中和、稀釋或薄膜過濾處理後再加人試驗菌懸液進行方法適用性試驗。
3 .抗菌活性的去除或滅活
供試液接種後,按下列“微生物回收” 規定的方法進行微生物計數。若試驗組菌落數減去供試品對照組菌落數的值小於菌液對照組菌落數值的50% ,可采用下述方法消除供試品的抑菌活性。
(1 )增加稀釋液或培養基體積。
(2 )加人適宜的中和劑或滅活劑。
中和劑或滅活劑(表2 )可用於消除幹擾物的抑菌活性,最好在稀釋液或培養基滅菌前加入。若使用中和劑或滅活劑,試驗中應設中和劑或滅活劑對照組,即取相應量稀釋液替代供試品同試驗組操作,以確認其有效性和對微生物無毒性。中和劑或滅活劑對照組的菌落數與菌液對照組的菌落數的比值應在0 .5〜2 範圍內。

(3 )采用薄膜過濾法。
(4 )上述幾種方法的聯合使用。
若沒有適宜消除供試品抑菌活性的方法,對特定試驗菌回收的失敗,表明供試品對該試驗菌具有較強抗菌活性,同時也表明供試品不易被該類微生物汙染。但是,供試品也可能僅對特定試驗菌株具有抑製作用,而對其他菌株沒有抑製作用。因此,根據供試品須符合的微生物限度標準和菌數報告規則,在不影響檢驗結果判斷的前提下,應采用能使微生物生長的更高稀釋級的供試液進行計數方法適用性試驗。若方法適用性試驗符合要求,應以該稀釋級供試液作為最低稀釋級的供試液進行供試品檢査。
4 .供試品中微生物的回收
表1所列的計數方法適用性試驗用的各試驗菌應逐一進行微生物回收試驗。微生物的回收可采用平皿法、薄膜過濾法或M PN法。
(1 )平皿法 平皿法包括傾注法和塗布法。表1 中每株試驗菌每種培養基至少製備2個平皿,以算術均值作為計數結果。
傾注法
取照上述“ 供試液的製備” “ 接種和稀釋”和“抗菌活性的去除或滅活” 製備的供試液lm l,置直徑90mm的無菌平皿中,注人15〜20ml溫度不超過45*C熔化的胰酪大豆腖瓊脂或沙氏葡萄糖瓊脂培養基,混勻,凝固,倒置培養。若使用直徑較大的平皿,培養基的用量應相應增加。按表1規定條件培養、計數。同法測定供試品對照組及菌液對照組菌數。計算各試驗組的平均菌落數。
塗布法
取15〜20ml溫度不超過4 5C的胰酪大豆腖瓊脂或沙氏葡萄糖瓊脂培養基,注人直徑90mm的無菌平皿,凝固,製成平板,采用適宜的方法使培養基表麵幹燥。若使用直徑較大的平皿,培養基用量也應相應增加。每一平板表麵接種上述照“供試液的製備” “接種和稀釋” 和“抗菌活性的去除或滅活” 製備的供試液不少於0.1ml。按表1規定條件培養、計數。同法測定供試品對照組及菌液對照組菌數。計算各試驗組的平均菌落數。
(2)薄膜過濾法 薄膜過濾法所采用的濾膜孔徑應不大於0.45pm,直徑一般為50mm,若采用其他直徑的濾膜,衝洗量應進行相應的調整。供試品及其溶劑應不影響濾膜材質對微生物的截留。濾器及濾膜使用前應采用適宜的方法滅菌。使用時,應保證濾膜在過濾前後的完整性6水溶性供試液過濾前先將少量的衝洗液過濾以潤濕濾膜。油類供試品,其濾膜和濾器在使用前應充分幹燥。為發揮濾膜的最大過濾效率,應注意保持供試品溶液及衝洗液覆蓋整個濾膜表麵。供試液經薄膜過濾後,若需要用衝洗液衝洗濾膜,每張濾膜每次衝洗量一般為100ml。總衝洗量不得超過1000ml,以避免濾膜上的微生物受損傷。
取照上述“供試液的製備” “ 接種和稀釋” 和“抗菌活性的去除或滅活” 製備的供試液適量(一般取相當於lg 、lm l或10cm2的供試品,若供試品中所含的菌數較多時,供試液可酌情減量),加至適量的稀釋液中,混勻,過濾。用適量的衝洗液衝洗濾膜。
若測定需氧菌總數,轉移濾膜菌麵朝上貼於胰酪大豆腖瓊脂培養基平板上;若測定黴菌和酵母總數,轉移濾膜菌麵朝上貼於沙氏葡萄糖瓊脂培養基平板上。按表1 規定條件培養、計數。每株試驗菌每種培養基至少製備一張濾膜。同法測定供試品對照組及菌液對照組菌數。
(3)MPN法 M P N法的精密度和準確度不及薄膜過濾法和平皿計數法,僅在供試品需氧菌總數沒有適宜計數方法的情況下使用,本法不適用於黴菌計數。若使用M P N法,按下列步驟進行。
取照上述“供試液的製備” “ 接種和稀釋” 和“ 抗菌活性的去除或滅活” 製備的供試液至少3 個連續稀釋級,每一稀釋級取3 份lm l分別接種至3 管裝有9〜10ml胰酪大豆腖液體培養基中,同法測定菌液對照組菌數。必要時可在培養基中加入表麵活性劑、中和劑或滅活劑。接種管置30〜35°C培養3 天,逐日觀察各管微生物生長情況。如果由於供試品的原因使得結果難以判斷,可將該管培養物轉種至胰酪大豆腖液體培養基或胰酪大豆腖瓊脂培養基,在相同條件下培養1〜2 天,觀察是否有微生物生長。根據微生物生長的管數從表3 查被測供試品每l g 或每lm l中需氧菌總數的最可能數。
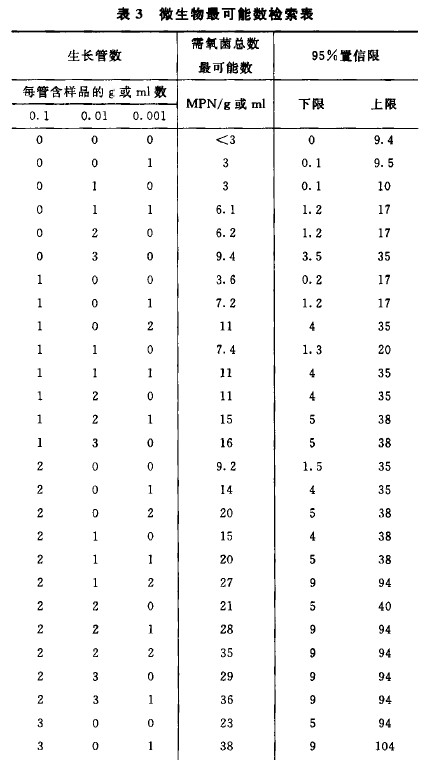
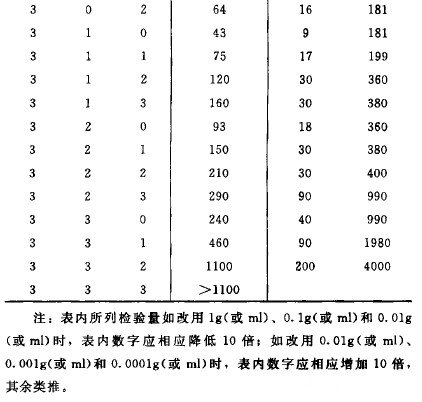
5. 結果判斷
計數方法適用性試驗中,采用平皿法或薄膜過濾法時,試驗組菌落數減去供試品對照組菌落數的值與菌液對照組菌落數的比值應在0 .5〜2 範圍內;采用M P N法時,試驗組菌數應在菌液對照組菌數的95%置信限內。若各試驗菌的回收試驗均符合要求,照所用的供試液製備方法及計數方法進行該供試品的需氧菌總數、黴菌和酵母菌總數計數。
方法適用性確認時,若采用上述方法還存在一株或多株試驗菌的回收達不到要求,那麽選擇回收最接近要求的方法和試驗條件進行供試品的檢査。
上一篇:無菌控製
下一篇:黴菌的生物學特征

