











一、參考標準
《GB5009.211-2014食品安全國家標準 食品中葉酸的測定》
二、方法原理
葉酸是鼠李糖乳杆菌Lactobacillus casei spp.rhamnosus(ATCC7469)生長所需的營養素,在一定控製條件下,將鼠李糖乳杆菌液接種至含有式樣液的培養液中,培養一段時間後測定透光率(或吸光度值),根據葉酸含量與透光率(或吸光度值)的標準曲線計算出試樣中葉酸的含量。
三、試驗用品及預處理
(1)培養基:葉酸測定用培養基。
(2)磷酸鹽緩衝液(0.05mol/L,PH6.8)、氫氧化鈉乙醇溶液(0.01mol/L)、雞胰腺溶液、蛋白酶-澱粉酶液純化水等。
(3)容器:試管、移液管、容量瓶、量筒、玻璃棒、錐形瓶。
注意事項:
1.本方法所用試劑均為分析純,水為GB/T 6682規定的二級水。水的潔淨程度對本試驗至關重要,若水中有葉酸殘留或接觸了有葉酸殘留的容器,將直接影響到試驗結果;
2.試驗中使用的玻璃器具需洗淨後在200℃烘至少2h,必要時可預先用1mol/L的稀鹽酸浸泡再烘,充分去除容器中可能殘留的葉酸;
3.使用的葉酸測定培養基需確保不含有葉酸,其他營養齊全。若自行配製培養基,需確保原材料中不含有葉酸,製備過程不可汙染葉酸。
四、標準溶液的製備
(1)葉酸標準貯備液(20.0 μg /mL):精確稱取20.0mg葉酸標準品,用氫氧化鈉乙醇溶液溶解轉移至1000mL棕色容量瓶中,定容至刻度。
(2)葉酸中間液(0.200ug/mL):用氫氧化鈉乙醇溶解將1.0mL葉酸貯備液定容至100mL棕色容量瓶。
(3)葉酸標準工作液(0.200 ng/mL):用水將1.0mL葉酸中間液定容至1000mL容量瓶。
注意事項:
1.標準溶液配製過程中使用的溶劑、容器必須確保無葉酸殘留;
2.葉酸貯備液存於棕色瓶中,於2℃-4℃冰箱可保存2年,中間液可保存1年,標準工作液臨用前配製。
四、菌株活化及菌懸液製備
(1)將鼠李糖乳杆菌(ATCC 7469)轉接至瓊脂培養基中,在37℃±1℃培養箱中培養20h-24h,連續傳中2代-3代。
(2)實驗前一天,取2mL葉酸標準工作液與4mL葉酸測定用培養液混勻,分裝至2支5mL離心管中,於121℃高壓滅菌 15 min 即為種子培養液。待冷卻後用接種環將活化的菌株轉種至2支種子培養液中,於37℃±1℃培養箱培養20h-24h。將種子培養液混勻,無菌操作下吸取0.5mL轉種至另2支已消毒但不含葉酸的培養液中,37℃±1℃培養6h,振蕩混勻,製成接種液,立即使用。
注意事項:製備菌株過程需注意嚴格進行無菌操作,防止汙染雜菌。
五、樣品處理
(1)直接提取法:稱取固體試樣或液體試樣0.5g-2g(精確到0.001g),轉入100mL錐形瓶中,加入80mL氫氧化鈉乙醇溶液,超聲振蕩2h-4h至試樣完全溶解或分散,用水定容至刻度。
(2)酶解提取法:稱取適量試樣(精確到0.001g),轉至100mL錐形瓶中,加入30mL磷酸緩衝液,振搖5min後,於121℃高壓水解15min;待試樣冷卻至室溫,加入1mL雞胰腺溶液(含有蛋白質、澱粉的試樣需另加入1mL蛋白酶-澱粉酶液)混合,加入3滴-5滴甲苯後,置於37℃±1℃培養箱內酶解16h-20h,取出轉入100mL容量瓶,加水定容至刻度,過濾。
注意事項:
1.形態為顆粒、粉末、片劑、液體的營養補充劑或強化劑、預混料;以飲料為基質或葉酸添加量>100ug/100g的食品可采用直接提取法;
2.以穀物、乳粉等為基質的配方食品如需計量基質本底葉酸含量,可采取酶提取法。
六、試驗步驟
(1)標準曲線製作:按下表順序加入水、標準曲線工作液和葉酸測定用培養基於試管中,做3個平行組。
|
試管 |
S1 |
S2 |
S3 |
S4 |
S5 |
S6 |
S7 |
S8 |
S9 |
S10 |
|
水(mL) |
5 |
4.75 |
4.5 |
4 |
3.5 |
3 |
2.5 |
2 |
1 |
0 |
|
0.200ng/mL標準曲線工作液(mL) |
0 |
0.25 |
0.50 |
1.00 |
1.50 |
2.00 |
2.50 |
3.00 |
4.00 |
5.00 |
|
培養基(mL) |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
注意事項:準備標準係列管時另準備一支標準0管(含0.00ng葉酸)不接種作為0對照管。
(2)試樣和酶空白係列管的製作:按下表順序加入水、試樣稀釋液和葉酸培養基於試管中,做3個平行組。
|
試管 |
1 |
2 |
3 |
|
水(mL) |
4.5 |
4 |
3 |
|
待測液(mL) |
0.5 |
1.0 |
2.0 |
|
培養基(mL) |
5 |
5 |
5 |
(3)滅菌:將所有試管置於121℃滅菌15min,滅菌結束後,迅速冷卻至30℃以下。
注意事項:不可滅菌時間過長或長時間在滅菌鍋中保溫,防止培養基中維生素成分過量降解;滅菌後的培養基宜當天使用。
(4)接種:用滴管或移液器向上述試管中各滴加1滴(約20μL)測試菌液(其中標準曲線管中空白0對照管除外)。
(5)培養:將試管放入恒溫培養箱內,37±1℃培養20h~24h。
(6)觀察:培養結束後,若0對照管有明顯的細菌增長,或與0對照管相比,標準0管透光率在90%以下,或標準係列管透光率最大變化量<40%,說明可能有雜菌或不明來源葉酸混入,需重做實驗。
(7)測定:將培養好的標準係列管、試樣和酶空白係列管用漩渦混勻器混勻。用未接種0對照管調節透光率為100%(或吸光度值為0),依次測定標準係列管、試樣和酶空白係列管的透光率(或吸光度值)。
注意事項:
1.在進行吸光度測定時,測量的OD值在0.2-0.8之間相對更準確,線性關係更好,若測得OD值超出範圍,可進行倍數稀釋再進行測定。
2.葉酸測定適宜的光譜範圍540nm-610nm。
(8)標準曲線製作及計算:以標準係列管葉酸含量為橫坐標,每個標準點透光率(或吸光度值)均值為縱坐標,繪製標準曲線。
試樣結果計算:從標準曲線查得試樣或酶空白係列管中葉酸的相應含量(Cx),如果3支試樣係列管中有2支葉酸含量在0.10ng-0.80ng範圍內,且各管之間折合為每毫升試樣提取液中葉酸含量的偏差小於10%,則可能繼續按式(2)、式(3)、式(4)進行結果計算,否則需重新取樣測定。
試樣稀釋液葉酸濃度按式(2)計算:

采用酶解提取法的試樣葉酸含量按式(4)計算:

注意事項:
1.液體試樣葉酸含量也可以微克每百毫升(ug/100mL)為單位;
2.以重複性條件下獲得的兩次獨立測定結果的算術平均值表示,結果保留三位有效數字。
七、實驗現象及標準曲線製作
(1)實驗現象:

(2)標準曲線製作:
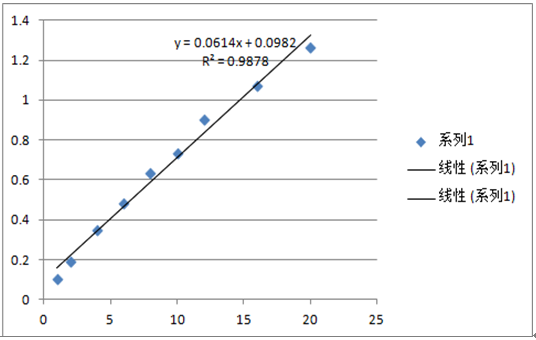
![]()
八、試驗關鍵點總結
(1)試驗用使用的玻璃容器、水、培養基等必須確保無維生素B12殘留,整個試驗過程操作要注意不能汙染葉酸,否則會導致標準曲線線性關係差或做不出標準曲線;
(2)標準溶液製備過程中必須精確稱量、定容,若配製的標準溶液誤差過大會直接影響最終測定結果;
(3)使用的鼠李糖乳杆菌要連續進行傳代至活力旺盛,且無雜菌汙染;在進行菌體離心-懸浮清洗的重複操作時,需確保清洗幹淨,不能有活化培養基殘留,殘留的培養基中可能含有葉酸,對試驗結果造成不良影響;
(4)進行OD值測定時,盡可能保證測得吸光度範圍在0.2-0.8之間,若超出此範圍,可使用空白培養基進行倍數稀釋後再進行測定。
注:本文屬betway必威西汉姆联生物原創,未經允許不得轉載。
上一篇:大腸埃希氏菌計數方法
下一篇:銅綠假單胞菌檢驗方法
| 相關文章: | |
| 應用微生物改良法測定紅細胞葉酸的研究 | |

